O hidróxido de potássio (KOH), comumente conhecida como “potassa cáustica” é uma base forte que existe na forma de um sólido branco cristalino, de coloração branca opaca ou transparente. É extremamente perigoso, em virtude de ser tóxico e corrosivo.
Reage violentamente e exotermicamente com água e com ácidos, produzindo um vapor sufocante e altamente corrosivo. O hidróxido de potássio é comercializado sob forma sólida comumente em escamas podendo às vezes estar na forma de flocos ou granulado ou soluções a 50%, sendo utilizado como matéria prima na indústria saboeira, além de diversas outras finalidades.
Propriedades Físico-Químicas
- Aspecto: sólido branco opaco ou solução transparente a 50%.
- Fórmula molecular: KOH
- Massa Molecular: 56,108 u
- Função Inorgânica: Bases
- Estado Físico: sólido nas CNTP.
Produção
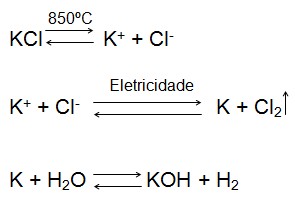
A maior parte do hidróxido de potássio utilizado é proveniente da eletrólise do KCl( cloreto de potássio), fundido a temperatura de 850ºC, onde a quebra da ligação ocorre pela passagem da corrente elétrica segundo reação:
Utilização
O KOH é uma base muito utilizada na indústria, em vários segmentos que vão desde matérias primas farmacêuticas a fertilizantes, em virtude de ser uma base de custo baixo, conferir ótimas propriedades aos produtos com ela formuladas.
Principais usos:
- A fabricação de sabões e detergentes entre outros produtos de limpeza. O KOH é usado na fabricação de sabões moles e transparentes, em virtude de conferir maior consistência e menos rigidez aos sabões, aumentando assim sua solubilidade.
- Na indústria cosmética é utilizada principalmente na fabricação de sabonetes em virtude de ser menos agressiva á pele do que os sabões de sódio.
- É usada na pesquisa sob a forma de reagente PA, tanto em titulações ácido base quanto em sínteses orgânicas e inorgânicas.
- Na fabricação de fertilizantes, em virtude do potássio ser indispensável para o crescimento das plantas. È comumente comercializado na forma de nitratos, nitritos, sulfatos e fosfatos de potássio todos obtidos pelasreações de neutralização com os respectivos ácidos.
Bibliografia:
SHRIVER, DUWARD; ATKINS, PETER. Química inorgânica – 4ª edição. Porto Alegre, Bookman, 2008.
LEE, J.D.. Química inorgânica não tão concisa – tradução da 4ª edição inglesa. São Paulo, Edgard Blücher, 1996.